מהו תהליך פיתוח מכשור רפואי?
פיתוח מכשור רפואי יכול להתבצע בשני מסלולים: המסלול הראשון הינו המסלול המהיר, והוא מתייחס לתהליך פיתוח מכשור רפואי הקיים כבר בשוק, כלומר שדרוגו של מכשור רפואי שבנמצא.
המסלול השני הינו מסלול פיתוח הכולל במסגרתו פיתוח מכשור רפואי מראשיתו ועד סופו. בדומה לפיתוחו של כל מוצר חדש, גם במסגרתו של פיתוח מכשור רפואי, התהליך מתחיל עם פיתוחו של אב טיפוס. בהמשך, מתקיימים ניסויים שונים לבדיקת בטיחותו של המכשור השונים ואישורו במשרד הבריאות.
לאחר שלב זה, יש לבצע מחקר קליני, בו נבדקת בטיחותו ויעילותו של המכשור הרפואי על קבוצת חולים גדולה. בסיום המחקר, ולאחר בחינת תוצאותיו, יתקבלו האישורים הרגולטוריים הנדרשים (ובהנחה שנמצא תקין) ומתחיל תהליך שיווקו של המכשיר. אך לא לפני שהמכשיר הרפואי נרשם כדת וכדין.
רישום אמ”ר וציוד רפואי בישראל – היכן מתחילים?
יבוא ומכירת מכשיר או אביזר המסווג כמוצר רפואי (אמ”ר) במדינת ישראל, מחייב רישום של המוצר במשרד הבריאות וקבלת אישור של אגף אמ”ר לצורך השלמת תהליך היבוא.
תהליך הבקשה לרישום הינו תהליך הדורש התמקצעות ומומחיות רבה. מדובר בתהליך מורכב אשר כולל בחינה ואיסוף מדוקדק של מסמכים רבים, הן מהיבואן והן מהיצרן ויש לבחון ולעמוד בנהלים והתקנים השונים והרגולציה החלה בהתאם לכל מכשיר רפואי ספציפי.
במאי 2021 נכנסה לתוקף הרגולציה החדשה באירופה, (MDR) והיא למעשה מהווה “קפיצת מדרגה” אשר הופכת את הניהול והעיסוק במכשירים רפואיים למורכב יותר, ומזכירה את הרגולציה המחמירה החלה על תרופות. הניסיון מלמד אותנו שבקרוב גם ארה”ב תאמץ את הרגולציה המחמירה יותר
במאמר זה נסקור את שלבי רישום אמ”ר בישראל.
מהי יחידת האמ”ר בישראל?
בשנת 1993, הוקמה במשה”ב (משרד הבריאות הישראלי) יחידת אמ”ר (אביזרים ומכשירים רפואיים).
אחריות אגף האמ”ר במשרד הבריאות, הנה ברישום אביזרים ומכשירים רפואיים, מתן היתרי יבוא לאמ”ר, מעקב אחר שיווק אמ”ר והנפקת מסמכים המסייעים ליצוא אמ”ר. האגף מפעיל מנגנון רישום, פיקוח ובקרה על ייצור, יבוא ושיווק אמ”ר.
אישור יבוא ורישום של אמ”ר במדינת ישראל
אגף אמ”ר במשרד הבריאות, מנפיק אישור ליבוא מכשירים ואביזרים רפואיים בהתאם לסיווג שלהלן:
| תדירות חידוש | סוג האישור | שם האישור |
| ניתן באופן ספציפי | נדרש כאשר מבקשים להכניס לישראל מוצר אשר אין לגביו צו יבוא חופשי | אישור יבוא חד-פעמי |
| אישור יבוא שנתי, אשר יש לחדשו בתחילת כל שנה קלנדרית | צו יבוא חופשי, מאפשר הכנסת מוצר או אביזר רפואי לישראל באופן חופשי במהלך אותה שנה קלנדרית בה ניתן האישור | אישור יבוא אמ”ר לפי צו יבוא חופשי |
| בהתאם לסוג המוצר | רישום מוצר בפנקס אמ”ר של משרד הבריאות המאפשר את מכירתו לקהל היעד כפי שהוגדר בגוף האישור ומחייב חידוש תקופתי. | אישור רישום אמ”ר בפנקס האביזרים של אמ”ר |
| בהתאם לסוג המוצר | אישור משרד הבריאות המאפשר מכירה חופשית של האמ”ר המסוים, לאחר שנצבר ניסיון וידע מספקים עבורו.
אישור זה מאפשר אף ייצוא של האמ”ר לחו”ל. |
אישור מכירה חופשית אמ”ר (Free Sale Certificate |
דוגמאות למוצרים הדורשים רישום אמ”ר
- תכשירי סיכה שאינם מכילים מרכיבים רפואיים נוספים (ללא חומרי חיטוי או אלחוש).
- נוזלים סינוביאליים.
- מוצרים ממלאי נפח (Fillers) חסרי פעילות תרופתית/פרמקולוגית, כגון נגזרות של חומצה היאלורונית, קולגן, ג’לטין.
- תמיסות סטריליות לטיפול בעדשות מגע לשימוש מחוץ לעין ובתוכה.
- תמיסות שטיפה סטריליות לשטיפה אורולוגית, לשטיפה בניתוחים שונים, או לשטיפת אף.
- שקיות לאיסוף דם המכילות חומרים נוגדי קרישה.
- קונדומים המכילים קוטלי זרע או מכוסים בחומרי סיכה.
- מוצרים דיאגנוסטיים לצביעת הקרנית.
- חומרים מקררים כמו אתיל-כלוריד.
- חומרים להלבנת שיניים (עד ריכוז של 6.5% מי חמצן).
רישום אמ”ר לאביזרים עם חומר תרופתי פעיל
תחת רישום אמ”ר יסווגו גם אביזרים רפואיים המכילים חומר תרופתי (לאחר קבלת חוות דעת מומחה).
בין אלה ניתן למצוא סטנטים המצופים בחומר תרופתי, אלקטרודות לשתלים אקטיביים (קוצבים, דפיברילטורים) שבקצה שלהם יש חומר תרופתי, או צמנט עצמות המכיל חומר תרופתי.
מוצרים אלה קרויים Combination products וככאלה מצריכים ידע ורמה מקצועית גבוהה הן בתחום הפארמצבטיקה והן האמ”ר על מנת לבצע את רישומם בהצלחה.
אסטרטגיה רגולטורית לרישום מכשור רפואי בישראל ובעולם
לפני שמחליטים שמסלול רישום לאמ”ר הוא המתאים ביותר, לא פעם אנו נתקלים באפשרויות טובות יותר לרישום המוצר, ואנו מציעים ללקוחותינו לבצע אסטרטגיה רגולטורית.
מטרת האסטרטגיה הרגולטורית היא לבחון האם המכשיר אכן נחשב כמתאים לרישום אמ”ר ולא כתכשיר רפואי, תוסף תזונה או תמרוק והאם ישנה “אפשרות מיקוח” מבחינה אסטרטגית-רגולטורית בהתאם לצרכי השוק והחברה, לצד רמת הסיכון של המוצר.
מסמך האסטרטגיה הרגולטורית אותו אנו מציעים מכיל את השוואת מסלולי הרישום השונים הן בישראל והן בעולם.
כחברת יעוץ הפעילה מזה 15 שנה בתחומי הביו-מד, שמנו לנו כמטרה לאפשר ללקוחותינו לא לעצור בשיווק המוצרים בישראל, אלא לאפשר להם למכור את המוצר בכל העולם ולכן מומלץ מאוד לכלול באסטרטגיה הרגולטורית גם את שווקי ארה”ב ואירופה.
האסטרטגיה הרגולטורית תכלול בנוסף להשוואת הדרישות הרגולטוריות, גם את הערכת ההשקעה הכספית הכרוכה בכל אחד מהם, לוחות זמנים, יתרונות וחסרונות.
כיצד מגישים בקשה לרישום אמ”ר?
הגשת הבקשה לצורך רישום אמ”ר מתחילה במילוי טופס באתר משרד הבריאות. הטופס מכיל את הנתונים הבאים:
- פרטים כלליים אודות זהות מגישי הבקשה, ופרטים על האמ”ר עבורו נדרש הרישום, כולל ההתוויה שלו ופרטי היצרן המלאים.
- תיאור כללי של האביזר על סמך מאפייניו (לדוגמא, האם הוא חשמלי, מושתל בגוף, פולט קרינה, מכיל תרופה כלשהי, האם הוא כולל חומר שיוצר מן החי ועוד).
- פירוט אישורים ותקנים שונים, כגון אישורי רשויות הבריאות או המוסד הבודק, אישור על בטיחות חשמלית, טרמית ועוד.
- פירוט הרמה המיקרוביאלית הנדרשת או הסטריליות של המכשיר והצורך בתהליכי עיקור לפני/במהלך ולאחר שימוש בו, כמו גם, פירוט על אופן ההפעלה שלו, הניקוי, השירות והתחזוקה.
לטופס הבקשה הבסיסי יש לצרף “תיק הגשה”, הכולל מסמכים רבים.
חשוב לציין כי, הגשת טופס חסר או לא מדויק עשויה לגרום עיכוב משמעותי בתהליך רישום האמ”ר, אשר יתבטא באובדן זמן ומשאבים.
בין המסמכים שיש להגיש:
- הצהרת היצרן והצהרת היבואן (DECLARATION OF FOREIGN MANUFACTURER ) בגין המכשור הרפואי, בנוסח שנקבע על ידי משרד הבריאות
- אישורים לאביזר או למכשיר מרשויות בריאות מוכרות בעולם (למשלFDA ,CE או רשויות הרגולציה באוסטרליה, יפן וקנדה)
- אישורי תקינה של היצרן וקבלני המשנה, קטלוגים וברושורים המציגים את הציוד, תוויות וחומרי הסברה, רישיון עסק של היצרן ופירוט האם המוצר נמכר בארץ ובעולם, והאם הוא כלול בסל הבריאות בארץ או במדינות אחרות.
יצוין כי בעת ההגשה הראשונית לצורך רישום אמ”ר, אין הכרח לצרף דוגמאות של המוצר, אלא על פי הצורך.
לאחר הגשת החומר במלואו, בהתאם להנחיות משרד הבריאות, המגיש אמור לקבל בתוך 7 ימים אישור על החומר ופתיחת תיק לרישום אמ”ר במשרד הבריאות.
אגף אמ”ר במשרד הבריאות דן בבקשה, ובודק את המסמכים הרבים שצורפו אליה. במידת הצורך נדרש היצרן או היבואן למסור מידע נוסף, להציג את המכשיר או האביזר ו/או להציג אסמכתאות נוספות.
רק לאחר בחינה מוקפדת ואישור של מכלול המידע והמסמכים שהתקבלו, אישור האמ”ר המיוחל יתקבל וניתן להכריז כי המוצר עבר בהצלחה תהליך רישום אמ”ר.
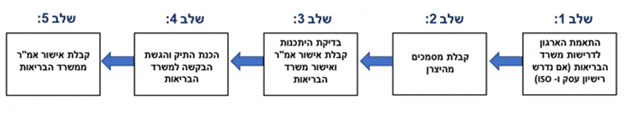
שלבי רישום האמ”ר בישראל
תהליך רישום אמ”ר במשרד הבריאות הישראלי, נחלק ל-5 שלבים, כמתואר בתרשים הבא:
סיווג אמ”ר לרישום בישראל
על אף העובדה כי למדינת ישראל אין סיווג משלה, היא כן מכירה באישורים המתקבלים מהרשויות הרגולטוריות המפורטות להלן. על החברה המעוניינת ברישום האמ”ר, יהיה להציג, בין היתר, אישור מאחת ממדינות המוכרות על ידי ישראל. לדוגמא:
- FDA 510 k
- אישור CE שהונפק על ידי גוף אירופי מורשה
- תעודה למדינה זרה (CFG) או תעודת מכירה חופשית (CFS)
עבור חברות המחזיקות באישור מאירופה ומארה”ב, תהליך הרישום הנו יחסית מהיר ובעל סיכוי הצלחה גבוה יחסית.
במידה והאמ”ר אינו רשום באחת ממדינות המוכרות בהתאם לתוספת הראשונה בחוק ציוד רפואי התשע”ב – 2012– יהיה על החברה להציג למחלקת אמ”ר במשרד הבריאות, בין היתר, גם את המסמכים הבאים:
- ניתוח סיכונים
- הערכה קלינית
- נתוני ניסוי קליני
- חוות דעת מומחה
מי יכול להיות בעל רישום אמ”ר בישראל?
“בעל רישום” מכשור רפואי בישראל חייב להיות נציג ישראלי של היצרן / בעל הזכויות בחו”ל ולכן, הליך הרישום של אמ”ר במדינת ישראל יבוצע באמצעות בעל רישום ישראלי – (IRH – Israeli Registration Holder)
על פי חוק, בקשות לרישום אמ”ר וציוד רפואי יכולות להתבצע רק על ידי אזרח ישראלי או על ידי חברה שהוקמה בישראל. חברות זרות, המתכוונות לייצא את המכשור הרפואי שלהן לישראל יצטרכו לפיכך לחבור לגורם שלישי במדינת ישראל אשר יהיה בעל הידע המתאים לתפקד כבעל הרישום הישראלי (IRH) ותחת אחריותו לפקח על תהליך רישום המכשיר הרפואי, לשמור ולתחזק את כל האישורים שניתנו על ידי אגף אמ”ר של משרד הבריאות וכמו כן לטפל בנושאי היבוא, האחסון, ההפצה והטיפול בחריגות ותלונות.
מהן חובותיו של בעל רישום האמ”ר?
בעל הרישום הוא מי שהגיש בקשה לרישום ציוד רפואי בפנקס הציוד הרפואי אמ”ר וקיבל תעודה המאשרת את רישום האמ”ר. לבעל הרישום של המכשור הרפואי בישראל אחריות רבה ובהתאם לכך גם חובות רבות:
| תחום | דרישות מבעל הרישום אמ”ר |
| אחריות מקצועית |
|
| בטיחות ואיכות |
|
| דיווח לאגף אמ”ר | על בעל הרישום לדווח לאגף ציוד רפואי (אמ”ר) על כל אירוע מיוחד שהגיע לידיעתו של בעל הרישום, הקשור בשימוש בציוד הרפואי הרשום, לדוגמא:
|
דרישות נוספות לרישום אמ”ר
חלק מהמכשירים הרפואיים אשר מבוססים על טכנולוגיה אלקטרו-רפואית נדרשים לקבל גם אישור של מכון התקנים הישראלי (ISI) על מנת להבטיח ולהוכיח את בטיחותם ואיכותם. על מנת לקבל את האישור ממכון התקנים הישראלי (ISI) -יש להגיש מכשיר רפואי לדוגמה יחד עם המסמכים הרלוונטיים.
עבור מכשור רפואי מבוסס תוכנה, יש צורך בביצוע ולידציה לתוכנה לפי דרישות הרגולציה של ארה”ב: -21CFR part 11 ו\או Annex 11
תהליך חידוש רישום מכשור רפואי (אמ”ר) בישראל
חידוש רישום אמ”ר בפנקס האמ”ר על מנת לחדש רישומו של מכשיר רפואי (אמ”ר) בפנקס האמ”ר, יש לנקוט בהליך מסודר, היות והרישום אינו מתחדש אוטומטית.
ציוד רפואי יירשם בפנקס האמ”ר לתקופה שלא תעלה על חמש שנים למעט הסוג שמפורט להלן:
- שתלים – עד שנתיים;
- ציוד רפואי הרשום או מותר בשיווק במדינה מוכרת – עד תום תוקפו של הרישום או ההיתר באותה מדינה, ובכל מקרה לא יותר מ- 5 שנים מיום הרישום בישראל.
את טופס החידוש לאמ”ר רשום בישראל, יש להגיש ארבעה חודשים לפני תום תוקף האישור הקיים. לאחר הגשת טופס החידוש, האישור לשיווק המכשור הרפואי ברוב המקרים, יוארך אוטומטית עד להחלטה פורמלית של משרד הבריאות בעניין חידושו.
תהליך הייעוץ לרישום אמ”ר
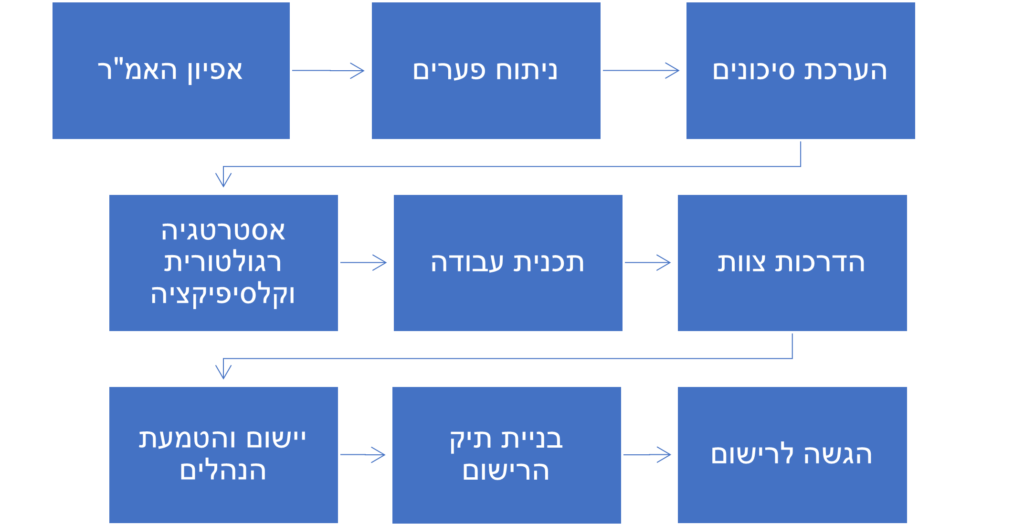
תהליך הליווי והייעוץ לרישום אמ”ר מחולק למספר שלבים:
- אפיון האמ”ר וצרכי הארגון בהתאם לרישום הנדרש
- ניתוח פערים וסקירה בסיסית של מסמכי האמ”ר
- הערכת סיכונים למוצר
- אסטרטגיה רגולטורית וקלסיפיקציה
- בניית תכנית עבודה המבוססת על הפערים, הסיכונים וצרכי הלקוח וכתיבה ואישור מסמכי ונהלי מדיניות רלוונטיים
- הדרכת צוותי הלקוח על השלמת הפערים, נהלים חדשים וכוץ
- יישום והטמעת הנהלים שנכתבו בעבודה השוטפת של הארגון
- הדרכה וייעוץ לקראת ביקורת (באם נדרשת)
- בניית התיק הטכני של האמ”ר
- הגשה לרישום אמ”ר
תרשים זרימה לרישום אמר וציוד רפואי בישראל