חברות מתחומי הביומד השונים, בין אם הן חברות יצרניות ובין אם מדובר במעבדות אשר משחררות מוצרים תרופתיים או רפואיים לשווקים, מחויבות לעמוד בדרישות ה- GMP.
חשוב לזכור שמדובר במוצרים או בדיקות מעבדה, אשר אם לא יבוצעו כהלכה, ברמות האיכות הנדרשות ובהתאם לעקרונות ה- GMP, יסכנו חיי אדם.
לאור רמות הסיכון הגבוהות, רשויות הבריאות מחויבות לבצע ביקורות GMP במתקני הייצור והמעבדות ברמה התקופתית וכמו כן לעיתים ללא כל התראה.
כל מי שלקח חלק בביקורת GMP של רשויות הבריאות, בין אם מדובר ברשויות הבריאות האמריקניות, אירופאיות או משרד הבריאות הישראלי, יודע שגם אם החברה נמצאת ברמת מוכנות גבוהה, תמיד ישנן הערות והפתעות ולעולם לא ניתן להיות בטוח שביקורת ה- GMP תעבור כצפוי.
על מנת לנסות לשפר את רמת המוכנות של החברה לקראת ביקורת GMP, חשוב להבין מהם ההערות או הטעויות הנפוצות ביישום GMP בחברות ביומד.
במאמר זה ננסה לתת כמה תחומים שמצריכים תשומת לב מיוחדת, לקראת ביקורת ה- GMP הקרובה.
מה זה GMP?
תנאי ייצור נאותים, Good Manufacturing Practice, או GMP הינם עקרונות מנחים לכל תהליכי ושלבי הייצור השונים, החל מקבלת חומרי הגלם ועד למוצר המוגמר, בתעשיות כגון הפרמצבטיקה, המזון, הקנאביס הרפואי, תוספי התזונה והמכשור הרפואי.
היות ותעשיות אלו מייצרות מוצרים רגישים, אשר עלולים בקלות להפוך ללא בטוחים ואף למסוכנים בשימוש, חשוב לפקח ולבקר את תנאי הייצור שלהם, מההתחלה ועד לשחרור המוצר למטופלים.
מטרת העל של עקרונות ה- GMP היא להבטיח את איכותו של המוצר על מנת לשמור על בטיחותו ובריאותו של המשתמש הסופי.
ביקורות GMP מבוצעות ע”י רשויות הבריאות מבוצעות תקופתית, ורק עם עברו בהצלחה תאושר המשך פעילות היצרן/המעבדה.
> לקריאה נוספת על ביקורות GMP ראה מהי ביקורת GMP וכיצד ניתן להתכונן אליה?<<<
אילו הערות נפוצות יותר בביקורות GMP?
במאמר זה נתייחס לכמה הערות שכיחות שמקבלים חברות וארגונים בתעשיות הפרמצבטיקה, המזון והמכשור הרפואי בביקורות GMP של רשויות הבריאות.
הערה בביקורת GMP- טיפול לא נכון באי התאמות וחריגות
דוגמא לחריגה שנתקלנו בה במהלך ביקורת GMP:
מספר האצווה שאמור לעבור בצורה ידנית למוצר לא עבר באופן נכון למוצר. תוצאות חקירת החריגה העלו כי הסיבה היא “טעות אנוש”. בנוסף נמצא כי החריגה הזו חזרה על עצמה 3 פעמים בשלושה חודשים.
לא נחקרו ולא הוערכו סיבות טכניות או ארגוניות אפשריות אחרות שיכלו לתרום לחריגה.
בהתאם לתנאי הייצור הנאותים GMP יש לבצע חקירה של סיבות השורש שהובילו לחריגה ולזהות את הסיבה הכי סבירה לחריגה.
בדוגמא שהבאנו, החקירה שבוצעה לא עזרה למנוע את הישנות הבעיה וזאת כיוון שהסיבה הסבירה שנמצאה הייתה רק השערה ראשונית שמחייבת שאלות נוספות, בדיקה והערכה עמוקה יותר.
מה לעשות כדי להימנע מטיפול לא נכון בחריגות?
ישנן כמה שיטות בהן אפשר להעזר על מנת לנתח סיבות לחריגה.
לא תמיד צריך לערוך תרשימים ודיאגרמות על מנת להבין לעומק את סיבות השורש לחריגה.
כאשר מנתחים את הסיבות לחריגה, כדאי להתחיל ולשאול כל פעם “למה?”
מבקר/איש QA:
למה העובד העביר את מספר האצווה בצורה לא נכונה?
מבוקר/עובד יצור:
בגלל שהעובד לא זיהה את מספר האצווה בהוראות הייצור
מבקר/איש QA:
למה העובד לא זיהה את המספר בהוראות הייצור?
מבוקר/עובד יצור:
בגלל שהוראות הייצור ממוקמות בחדר הבקרה של התהליך אשר סמוך לו, יחסית רחוק מהעובד וקשה לראות את המספר בבירור.
מבקר/איש QA:
למה הוראות הייצור שבהן אמור עובד הייצור להשתמש, ממוקמות כל כך רחוק ממנו?
מבוקר/עובד יצור:
הוראות הייצור לא ממוקמות על השולחן כדי למנוע זיהומים באיזור הייצור ולכן ממוקמות במרחק אשר מקטין את הסיכון
ע״י שימוש בשאלות בצורה זו, אנחנו יכולים להתקרב לסיבה האמיתית שהובילה לחריגה.
תרשים זה מדגים את שיטת השאלות כאשר כל חץ מייצג את השאלה “למה”.
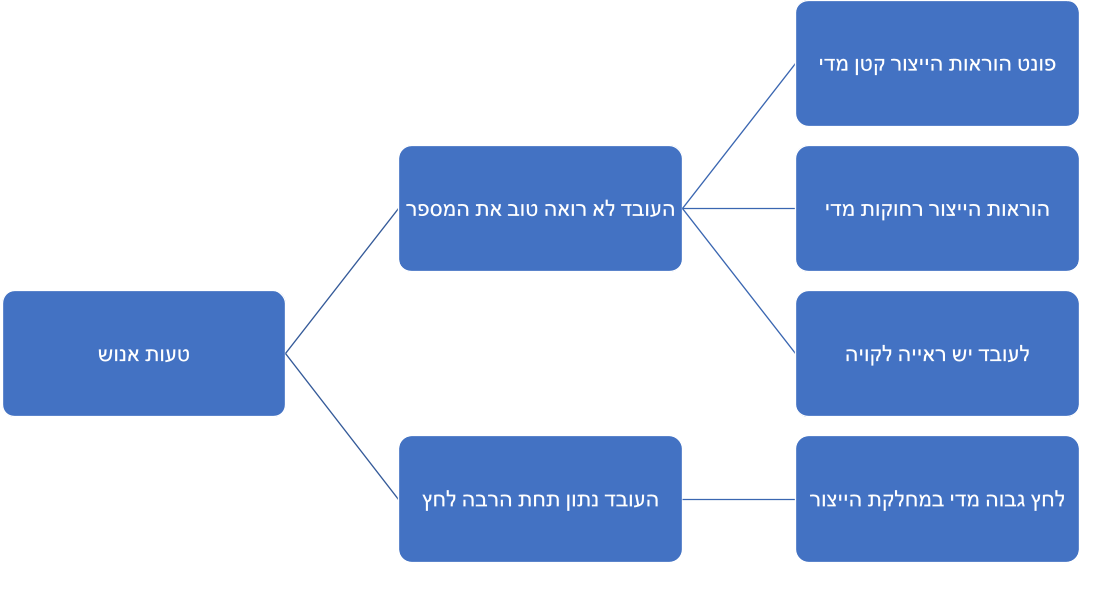
רק כאשר מצאנו את הסיבה ההגיונית ביותר לחריגה ניתן להגיב ולנקוט באופן הפעולה היעיל ביותר.
למשל, בדוגמא שהבאנו, אם מסתבר כי ההעברה הלקויה של מספר האצווה למוצר, התרחשה בגלל העובדה שמסמך הוראות הייצור ממוקם רחוק מהעובד, הרי שניתן לארגן את סביבת העבודה בצורה אחרת, טובה יותר כך שיהיה לעובד נוח וקל יותר לקרוא את המספר הנכון.
אם נצא מנקודת הנחה שאכן ברוב הפעמים מתרחשת טעות אנוש והפעולה המתקנת תמיד תהיה מתן הדרכה נוספת לעובד שטעה, תמיד תתרחש טעות נוספת בין אם של אותו עובד או עובד נוסף שיטעה ולכן זו אינה פעולה אפקטיבית ליישום ומניעה.
אם נניח שמדובר בראייה לקויה של העובד הרי שפעולה מתקנת תהיה לשלוח אותו לרופא עיניים, אבל החריגה ככל הנראה תתרחש שוב, כל עוד מסמך ההנחיות מונח רחוק ולא נראה בקלות לעובדים.
הערה בביקורת GMP- טיפול לא נכון בשינויים
דוגמא נוספת בה נתקלנו במהלך ביקורת GMP:
נוהל שינויים בארגון קובע כי שינויים צריכים לקבל אישור לפני שהם מוטמעים בארגון.
בהתאם להוראות נוהל בקרת שינויים, מוקמת ועדת אשר דנה בשינויים ובאישורם, אך הרכב הוועדה לא נקבע מראש, אלא היה משתנה בהתאם לבקשת השינוי ולתחומים הרלוונטיים.
כיוון שכך, לא היה ברור כיצד להבטיח שכל העובדים הרלוונטיים אכן יהיו מעורבים בתהליך אישור השינוי, למשל, מנהל השיווק, מנהל הייצור, מנהל האיכות וכו’.
היות ומערכת לבקרת שינויים כוללת תהליכים חוצי ארגון, השינויים כוללים תחומי אחריות שונים ומגוונים.
בדרך כלל הארגון קובע ועדה ואת חברי הוועדה הכלולים בה ואולם, היות שתחומי האחריות הקשורים בשינויים יכולים להיות מגוונים, לא תמיד יש צורך בכל העובדים שנקבעו מראש, במיוחד כאשר מעורבותם בתהליך, מגיעה על חשבון העבודה שלהם.
בשל כך, ישנם ארגונים שמפצלים את הרכב הצוות לחקירת שינויים, למחלקות ייעודיות לפי התחומים השונים, אך יש לכך גם חסרונות.
במקרה נוסף שנתקלנו בו, נכתב בבקשת השינוי כי תהליך הטמעת השינוי כרוך בביצוע שלבים רבים וייקח זמן רב עד להשלמת השינוי, ואולם, הבקשה לשינוי כבר נסגרה בטרם הושלמו כל המשימות. בנוסף, אפקטיביות השינוי המוטמע בהשגת מטרות האיכות, לא תועדה בבקשה לשינוי.
במקרים שתוארו ניתן לראות שאין בקרה על ההטמעה של תהליך השינוי וגם לא על האפקטיביות בביצועו. הבקשה לשינוי צריכה להיסגר רק לאחר שכל הצעדים הוטמעו ואפקטיביות השינוי נבדקה ותועדה, גם אם משמעות הדבר שהבקשה תישאר פתוחה זמן רב.
מה לעשות כדי להימנע מטיפול לא נכון בשינויים?
כדי להמנע מעיכובים מיותרים באישור ויישום שינויים, כדאי לקבוע לגבי כל בקשה לשינוי מהם לוחות הזמנים בהם צריך לעמוד בכל שלב בתהליך. בהתאם ללוחות הזמנים שנקבעו, יש לבצע מעקב.
אם לא ניתן לעמוד בלוחות הזמנים שנקבעו, יש לתעד את המצב, להעריך אותו ולפעול בהתאם.
ישנה אפשרות להשתמש, במידת הצורך, במערכת תוכנה על מנת לנהל את הבקשות לשינוי. מערכות אלו יכולות למשל “להפעיל” את הבקשה בהתאם ללוחות הזמנים שנקבעו, כדי לעזור בניטור ההטמעה.
הערה בביקורת GMP- פער בין הכתוב הנהלים ומה שמבוצע בשטח
דוגמא נוספת בה נתקלנו במהלך ביקורת GMP:
אשר אני מבצע ביקורת GMP אצל לקוח, לאחר פגישת הפתיחה של הביקורת וקבלת כל האינפורמציה על המתקן, המוצרים ותהליכי הייצור, אני מבקש לצאת לסיור בשטח.
ברוב החברות, מערכת ניהול האיכות וה- GMP מכילה את המסמכים הנדרשים. גם אם הנהלים כתובים לפי דרישות הרגולציה, כמעט תמיד כשאני בוחן תהליך על רצפת הייצור, ומבקש לראות לפי איזה נוהל עובדים, אני מוצא שהנוהל לא מיושם כנדרש, אלא רק באופן חלקי.
לעיתים חוסר היישום או היישום החלקי של נוהל או הוראות עבודה, נובע מחוסר יכולת של העובד או של המערכת לבצע את הנדרש הלכה למעשה ויש לבצע עדכון לנוהל.
מה לעשות כדי להימנע מפערים בין הכתוב בנהלים לבין המבוצע בשטח?
כדי להמנע מפערים בין מה שמוגדר במסמכי מערכת האיכות, כגון נהלים, הוראות עבודה, יצור, ניקיון וכדומה, לבין מה שמבוצע בשטח, יש לכתוב את הנהלים “מלמטה למעלה”.
בבואנו להקים מערכת איכות, אנו צריכים לשאול את עצמנו ראשית מהו סוג המוצר אותו אנו מייצרים, מהי רמת הסיכון אליה אנו חשופים בתור יצרנים ומה יש להקפיד עליו בתהליכים המבוצעים בחברה.
לאחר מכן, יש לקרוא את דרישות הרגולציה ובהסתמך על רמות הסיכון להגדיר במדויק כיצד אנו מיישמים את דרישות האיכות וה- GMP אצלנו בחברה.
מערכת לניהול איכות ו-GMP לא אמורה להראות אותו הדבר בין שתי חברות. לכל חברה יש את המוצר שלה, את הטכנולוגיות והמערכות בהן היא משתמשת על מנת לייצר, את הסיכונים שלה ואת מתקן הייצור שלה.
כאשר כל נוהל אשר אנו אמורים לכתוב, יכתב “מרצפת הייצור” ולא מהמשרדים, כך הפער בין הכתוב לבין המבוצע בשטח, יצטמצם.
חברת ביו-כם מעניקה שירותים מקיפים לרבות הכשרות לעובדים וחברות בנושאי תנאי ייצור נאותים.




